Döbereiner, en 1817, declaró la similitud entre las propiedades de algunos grupos de elementos, que variaban progresivamente desde el primero al último. Veinte años después, en 1827, destacó la existencia de otras agrupaciones de tres elementos, que seguían una análoga relación entre sí.
Estos grupos eran:
- Cloro, bromo y yodo
- Azufre, selenio y telurio
- Litio, sodio y potasio
De estos grupos de tres se continuaron encontrando, hasta que en 1850 ya se tenía conocimiento de entorno a 20 triadas.
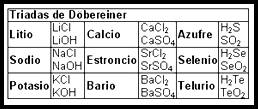
Döbereiner hizo un intento de relacionar las propiedades y semejanzas químicas de los elementos y de sus compuestos, con las características atómicas de cada uno de ellos, que en ese caso se trataba de los pesos atómicos, viéndose un gran parecido entre ellos, y una variación progresiva y gradual desde el primero hasta el tercero o último de la triada.