Eaglesfield, Gran Bretaña, 1766-Manchester, 1844) Químico y físico británico. En su infancia ayudaba con su hermano a su padre en el trabajo del campo y de la pequeña tienda familiar donde tejían vestidos, mientras que su hermana Mary ayudaba a su madre en las tareas de la casa y vendía papel, tinta y plumas.
Jonh Dalton

Aunque su situación económica era bastante humilde, recibieron cierta educación en la escuela cuáquera más cercana, a diferencia de otros niños de la misma condición. El maestro de la escuela cuáquera de Pardshow Hall proporcionó a Jonh Dalton una buena base y le transmitió afán por la búsqueda incansable de nuevos conocimientos. Un cuáquero rico, Elihu Robinson, se convirtió en su mentor y en otra fuente de estimulación hacia las matemáticas y las ciencias (especialmente la meteorología).
Con sólo 12 años de edad Jonh Dalton abrió una escuela en su localidad natal, Eaglesfield. Aunque supo manejar los problemas con sus alumnos mayores que él, después de dos años tuvo que abandonar su proyecto debido al bajo salario, y tuvo que volver a las tareas del campo trabajando para un tío suyo.
En 1781 Jonh Dalton se unió a su hermano como asistente de George Bewley en su escuela de Kendall. Cuando se retiró George, su hermano y él abrieron su propia escuela, donde ofrecían clases de inglés, latín, griego y francés, además de 21 temas relacionados con las matemáticas y las ciencias. Su hermana se trasladó con ellos para ayudarles en la casa. A pesar de tener unos 60 alumnos, a veces se veían obligados a trabajar en tareas auxiliares para mantenerse.
John Gough, el hijo ciego de un rico comerciante, se hizo amigo de John Dalton y su mentor. Le enseñó lenguas, matemáticas y óptica, además de compartir con Dalton su biblioteca. El interés de Dalton se extendió hacia la neumática, la astronomía y la geografía, y en 1787 comenzó a obtener ingresos extraordinarios impartiendo conferencias. También se dirigió a un museo cercano con una oferta para vender los once volúmenes clasificados de su colección botánica. Coleccionaba mariposas y estudiaba los caracoles, las garrapatas y los gusanos. También medía su ingesta de alimentos y la comparaba con los residuos producidos por sus organismo. Preparaba su ingreso en la escuela de medicina, pero su familia lo desanimó por falta de dinero y de confianza en él.
A la edad de 26 años (1792), Dalton descubrió que ni él ni su hermano eran capaces de distinguir los colores. Le regaló a su madre unas medias (que él creía azules) y ella le preguntó sorprendida cuál era la razón por la que le daba unas medias de color escarlata, que no era apropiado para una mujer cuáquera. En su primer artículo científico importante, John Dalton proporcionó una descripción científica sobre este fenómeno que posteriormente se conoció con el nombre de daltonismo.
En 1793, se trasladó a Manchester como tutor en el Nuevo Colegio fundado por los presbiterianos. Inmediatamente se inscribió en la Biblioteca de Manchester y en la Sociedad Filosófica (que llegaría a presidir). En ese mismo año Dalton publicó su primer libro Meteorological Observations and Essays, donde defendía la tesis de que el aire es una mezcla física de gases en lugar de una combinación química. Como tutor de química conocía la obra de Lavoisier.
En 1802 estableció su ley de las presiones parciales (Ley de Dalton). Cuando dos fluidos elásticos A y B se mezclan, no hay repulsión entre una partícula de A y otra de B, pero sí entre una partícula de B y otra partícula de B. También estableció una relación entre la presión de vapor y la temperatura. Su interés en los gases se derivaba de su afición a los estudios meteorológicos: siempre llevaba consigo sus aparatos del tiempo allí donde fuese, realizando a lo largo de su vida más de doscientas mil observaciones que anotaba en su diario constantemente. Gracias a estas observaciones, su mente analítica pudo encontrar relaciones numéricas entre los datos.
En 1803, mientras trataba de explicar su ley de presiones parciales, comenzó a formular su mayor contribución a la ciencia: la teoría atómica. Se encontraba estudiando la reacción del óxido nítrico con oxígeno cuando descubrió que la reacción podía tener lugar con dos proporciones diferentes: a veces 1:1,7 y otras 1;3,4 (en peso). Ello llevó a Dalton a establecer la ley de las proporciones múltiples, que dice que los pesos de dos elementos siempre se combinan entre sí en proporciones de números enteros pequeños. En ese mismo año publicó su primera lista de pesos atómicos y símbolos.En él adoptó la idea de átomo y dibujó partículas individuales para ilustrar las reacciones químicas. No todo el mundo aceptaba la nueva teoría y en 1810 publicó la segunda parte, proporcionando nuevas evidencias empíricas.
Aunque fue miembro de la Real Sociedad desde 1822 y en 1825 recibió la medalla de esta sociedad científica por su trabajo en la teoría atómica, Dalton siempre se consideraba a sí mismo sobre todo un docente, que se ganó la vida dando clases y conferencias hasta 1833, cuando fue premiado con una pensión civil anual. El 27 de julio de 1844 falleció de un ataque al corazón. Según su deseo, tras su muerte se le practicó la autopsia para determinar la causa de lo que luego se llamó daltonismo. Su último experimento demostró que el daltonismo no es un problema del ojo mismo, sino que estaba causado por alguna deficiencia del poder sensorial. Fue enterrado con honores de monarca, en un funeral seguido por más de cuatrocientas mil personas, contraviniendo los principios de los cuáqueros conforme a los cuales vivió.
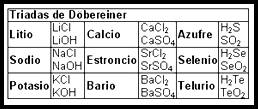















 La química inorgánica es la rama de la química que estudia las propiedades, estructura y reactividad de los compuestos inorgánicos.
La química inorgánica es la rama de la química que estudia las propiedades, estructura y reactividad de los compuestos inorgánicos.